近日,首都医科大学宣武医院神经外科洪韬、张鸿祺教授团队,在血管机制研究知名期刊《Angiogenesis》杂志上发表了题为 “Somatic BrafV600E mutation in the cerebral endothelium induces brain arteriovenous malformations”的研究论文。基于该团队前期发现的脑动静脉畸形KRAS或BRAF体细胞突变遗传机制,该工作证明BRAF单基因突变能够导致小鼠脑动静脉畸形的发生,成功构建高度模拟人类病变的脑动静脉畸形动物模型研究平台,阐述病变形成的病理生理过程,并提供了可能的药物治疗靶点。首都医科大学宣武医院神经外科涂天琦博士研究生、于嘉兴副研究员和姜晨旦医师为共同第一作者,首都医科大学宣武医院神经外科于嘉兴副研究员、张鸿祺教授和洪韬教授(末位通讯)为文章共同通讯作者。

脑 动 静 脉 畸 形(brain arteriovenous malformation,BAVM)是一类复杂难治的脑血管结构异常疾病,受限于复杂的血管构筑及其与脑组织密切的解剖关系,目前的外科治疗对许多BAVM病例束手无策。因此,探究疾病发生的分子机制,寻找潜在药物靶点是当前亟须解决的关键问题。但由于缺少理想的动物模型,导致BAVM领域的机制研究较难开展。
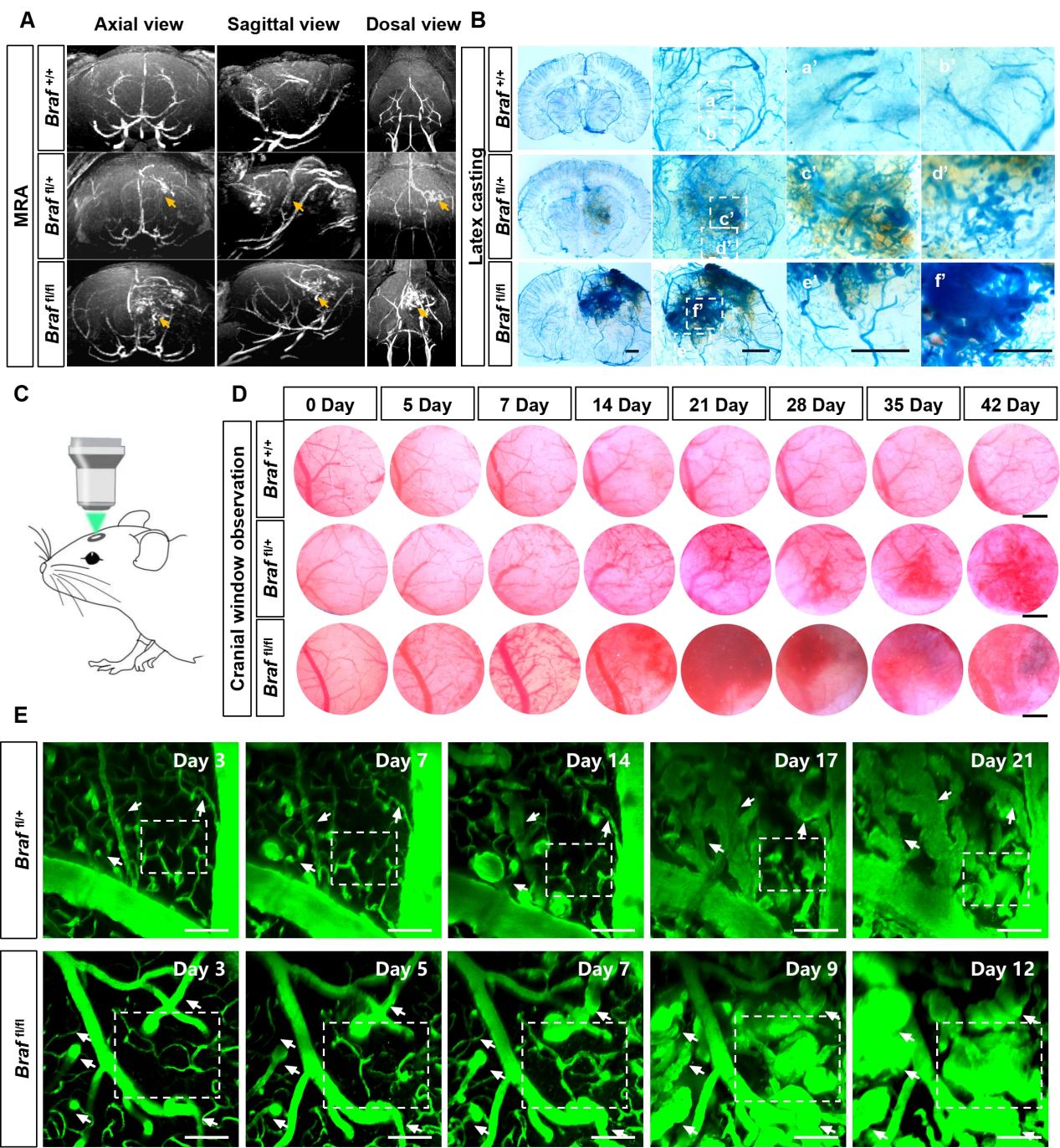
成功建立与临床病变特征密切相似的小鼠BAVM模型并动态观察其发生过程
此前,该研究团队报道了KRAS/BRAF体细胞激活突变是散发脑动静脉畸形的核心遗传机制,为构建动物模型提供了新可能。该研究通过立体定向注射AAV-BR1-Cre的方式在小鼠特定脑区诱导内皮细胞BrafV600E突变的方法,成功建立了遗传突变、病理形态和临床表现都与人类疾病特征高度相似的小鼠BAVM模型,可观察到血管壁稳定性下降、自发性出血等典型人类BAVM病理生理改变,病变大小、位置稳定,可通过小鼠核磁动态活体观察干预结果,便于进行干预性研究。通过该小鼠模型,研究揭示了BAVM主要起源于预先存在的微血管扩张,这个过程涉及单个内皮细胞体积的增加、部分内皮细胞的增殖及血流动力学的改变。单细胞转录组结果提示BAVM中内皮细胞形态变化、黏附、迁移能力的变化及细胞间连接的稳定性下降等因素可能是导致血管扩张性重塑和血管壁稳定性下降的原因。此外,早期使用BRAF抑制剂达拉非尼能有效减缓BAVM的进展,然而其治疗已建立的AVM病变的疗效尚不确定。
该研究构建了高度模拟人类病变的体细胞BRAF V600E突变的脑动静脉畸形小鼠模型,借助该模型首次阐述了从突变到病变发生发展的过程。未来利用这一小鼠模型进行的机制研究和药物干预研究将为该病的分子机制的解析提供新的见解,并有助于开发新的治疗策略。
该研究受国家自然科学基金项目(No. 81971104, 82122020, 82101369,82201439)的支持,以及北京市教育委员会 (BPHR20220113)基金项目的支持。

