糖尿病性心肌病(DCM)被定义为糖尿病患者在没有高血压、冠状动脉疾病或明显瓣膜疾病的情况下,与左心室功能障碍相关的病理生理状态。其特点为早期左室肥大、间质纤维化、糖尿病微血管病变及相关的异常舒张功能障碍,以及左室射血分数降低,最终导致心力衰竭。DCM的病理过程包括全身性胰岛素抵抗、能量代谢紊乱、线粒体功能障碍、氧化应激增加、钙处理不当和炎症。然而,对于DCM的治疗尚无具体的策略。
线粒体是心脏能量代谢的主要部位。线粒体功能的改变是导致DCM的主要原因。生理上,细胞内三磷酸腺苷(ATP)由各种能量底物产生,用于心脏功能;40-60%的ATP由脂肪酸的β-氧化产生(FAO), 10%-20%由丙酮酸(葡萄糖和乳酸)产生,2%-8%由酮体和氨基酸产生。然而,随着糖尿病的发展,心脏胰岛素抵抗和高脂血症抑制了葡萄糖的利用,导致90%-100%的FAO无法满足人体的能量需求,从而导致严重的心脏脂肪毒性,降低了能量生产的灵活性和效率。
线粒体通过生物发生、融合和裂变等一系列动态过程改变形态,以响应高能量需求,这被称为线粒体动力学。动力蛋白相关蛋白1 (Drp1)和裂变蛋白1 (Fis1)是参与线粒体裂变反应的主要蛋白。线粒体内外膜的融合事件由有丝分裂蛋白1/2 (Mfn1/Mfn2)和视神经萎缩蛋白1 (Opa1)驱动。在DCM患者和动物模型的心脏中观察到异常的线粒体动力学。
泛素化是一种重要的翻译后修饰,由E3泛素连接酶介导,它将泛素分子结合到靶蛋白底物上,随后被蛋白酶体识别并降解。去泛素化是与泛素化相反的过程。这两个事件维持着动态平衡,调节着体内重要的生物过程。泛素特异性蛋白酶7 (USP7),也被称为疱疹病毒相关泛素特异性蛋白酶(HAUSP),是去泛素酶最大亚家族——泛素特异性蛋白酶(USP)家族的成员。
据报道,USP7与多种心血管疾病有关。如扩张型心肌病患者左心室USP7异常升高,通过去泛素化修饰P53介导心脏损害的发生;USP7通过Sp1/Sp3-Notch1轴介导内皮细胞的病理生理性血管生成;USP7受miR-409-5p的负调控,miR-409-5p在缺血/再灌注小鼠心脏中通过p53/TfR1信号通路介导铁凋亡;此外,SIRT1/USP7轴介导阿霉素诱导的老年小鼠心脏毒。然而,USP7在DCM患者心脏能量代谢中的关键作用尚未报道。因此,它们被认为是代谢和心脏疾病有价值的治疗靶点。

图片来源:https://doi.org/10.1016/j.phrs.2024.107235
近日,来自广东省中西医结合代谢性疾病研究中心的研究者们在Pharmacol Res杂志上发表了题为“USP7 promotes cardiometabolic disorders and mitochondrial homeostasis dysfunction in diabetic mice via stabilizing PGC1β”的文章,该研究揭示了USP7通过稳定PGC1β促进糖尿病小鼠心脏代谢紊乱和线粒体稳态功能障碍,提出了一种对糖尿病小鼠的心脏发保护作用的策略。
糖尿病性心肌病(DCM)是糖尿病的主要并发症,以左心室功能障碍为特征。目前,对DCM缺乏有效的治疗方法。泛素特异性蛋白酶7 (USP7)在多种疾病中起关键作用。但USP7是否参与DCM尚未确定。
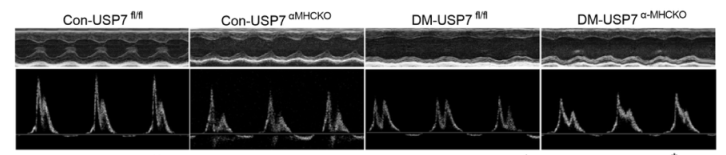
抑制USP7可减轻糖尿病小鼠心脏功能障碍
图片来源:https://doi.org/10.1016/j.phrs.2024.107235
在这项研究中,研究者证明了USP7在糖尿病小鼠心脏和与HG+PA共同处理的nmcm或与PA共同处理的H9c2细胞中上调。通过条件基因敲除或化学抑制USP7沉默,可以逆转糖尿病心脏形态和功能的异常。蛋白质组学分析结合生化验证证实PCG1β是USP7的直接蛋白底物之一,并通过共激活PPARα信号通路加重心肌损伤。USP7沉默通过抑制线粒体裂变和促进融合事件,恢复脂肪酸代谢相关蛋白的表达,恢复线粒体稳态。在体外也观察到类似的效果。该研究数据表明,USP7通过稳定PCG1β促进心脏代谢紊乱和线粒体稳态功能障碍,这表明沉默USP7可能是一种治疗DCM的策略。

USP7/PGC1β轴介导糖尿病小鼠心脏DCM病理过程的图形摘要
图片来源:https://doi.org/10.1016/j.phrs.2024.107235
综上所述,USP7沉默通过去泛素化调节PGC-1β介导的心脏代谢和线粒体稳态,对糖尿病小鼠的心脏发挥心脏保护作用。


