所选基因外显子上的CAG三核苷酸扩张导致了一系列神经退行性疾病,称为多谷氨酰胺(PolyQ)病,包括亨廷顿病(HD)。HD是一种迟发性疾病,以不受控制的运动(舞蹈症)、情绪障碍和精神症状为特征。
HD最显著的病理特征是纹状体神经元优先丢失。在晚期HD患者中,在其他大脑区域发现了神经变性,如皮质,而小脑中的神经元基本上幸免于难。揭示脑区特异性神经退行性变的机制是了解HD发病机制和开发有效的HD治疗方法的关键。
HD的致病基因是亨廷顿蛋白(Huntingtin,HTT),它编码3000多个氨基酸的大蛋白。HTT蛋白在PolyQ区域含有超过36种谷氨酸,被认为是突变的,容易发生错误折叠。突变型HTT(MHTT)被包括caspase-3、caspase-6和calain在内的多种酶切割。
由此产生的N-末端mHTT片段与扩展的多Q重复序列相比,比全长mHTT毒性更大,并形成通常在HD患者大脑中发现的包含体。虽然越来越多的证据表明,延长CAG重复的HTT转录本可以导致RNA介导的毒性,但mHTT蛋白仍被认为是HD发病的主要原因。
MHTT蛋白在脑和外周组织中广泛表达,但在HD中优先引起纹状体神经变性,其中中等刺神经元(MSN)最脆弱。已经投入了大量的努力来建立HTT表达水平与不同脑区神经元脆弱性之间的因果关系。使用死后人脑组织进行的研究得出了不一致的结果。
在全身水平上,纹状体内未见HTT的聚集。然而,免疫组织化学研究报告了hTT表达的脑区异质性,在纹状体中的特定神经元中有密集的标记。这种差异可能是由于样本条件的差异造成的,而这些条件对于死后的人体组织来说是很难控制的。另一方面,在广泛使用的HD啮齿动物模型中,HTT的表达与神经元脆弱性之间缺乏相关性的报道。

图片来源:https://pubmed.ncbi.nlm.nih.gov/38758800/
近日,来自暨南大学的研究者们在Science Advance杂志上发表了题为“TRIM37 is a primate-specific E3 ligase for Huntingtin and accounts for the striatal degeneration in Huntington’s disease”的文章,该研究揭示了TRIM37是一种灵长类动物特有的亨廷顿蛋白E3连接酶,与亨廷顿病的纹状体变性有关。
亨廷顿病(HD)是一种常染色体显性遗传性神经退行性疾病,以纹状体神经元优先丢失为特征。纹状体选择性神经变性的机制尚不清楚,这使得开发有效的治疗HD变得困难。在非人类灵长类动物的大脑中,研究者检测了亨廷顿蛋白(HTT)的表达,这是导致HD的基因。
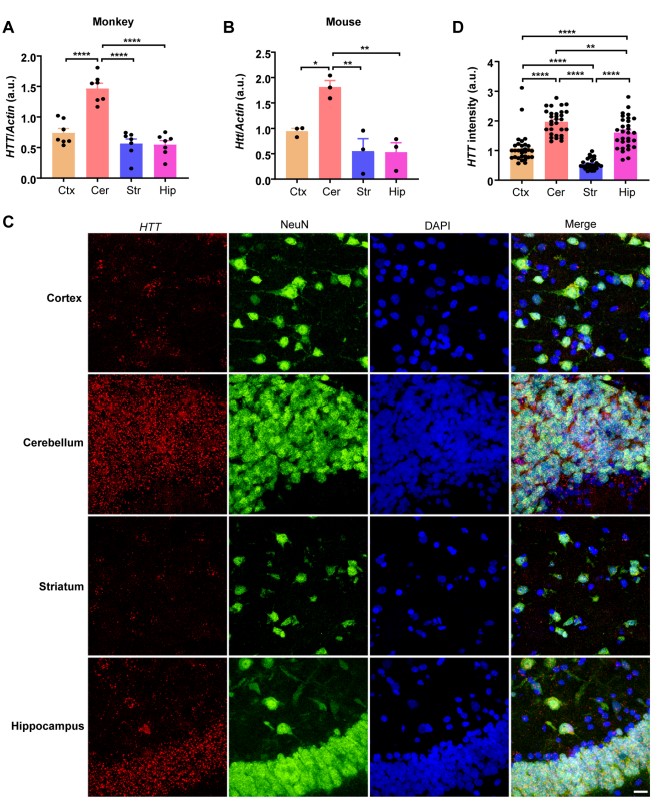
猕猴不同脑区HTT基因表达的特征
图片来源:https://pubmed.ncbi.nlm.nih.gov/38758800/
研究者发现HTT蛋白在纹状体神经元中的高表达是由于其在纹状体中的缓慢降解。研究者还发现含有三聚体基序的37(TRIM37)是一种与HTT相互作用的灵长类特异蛋白,在灵长类纹状体中选择性地被还原。
TRIM37在体外促进突变型HTT(MHTT)的泛素化和降解,并调节mHTT在小鼠和猴子脑中的聚集。本研究发现表明,非人类灵长类动物对于理解人类疾病如HD的机制至关重要,并支持TRIM37作为治疗HD的潜在治疗靶点。
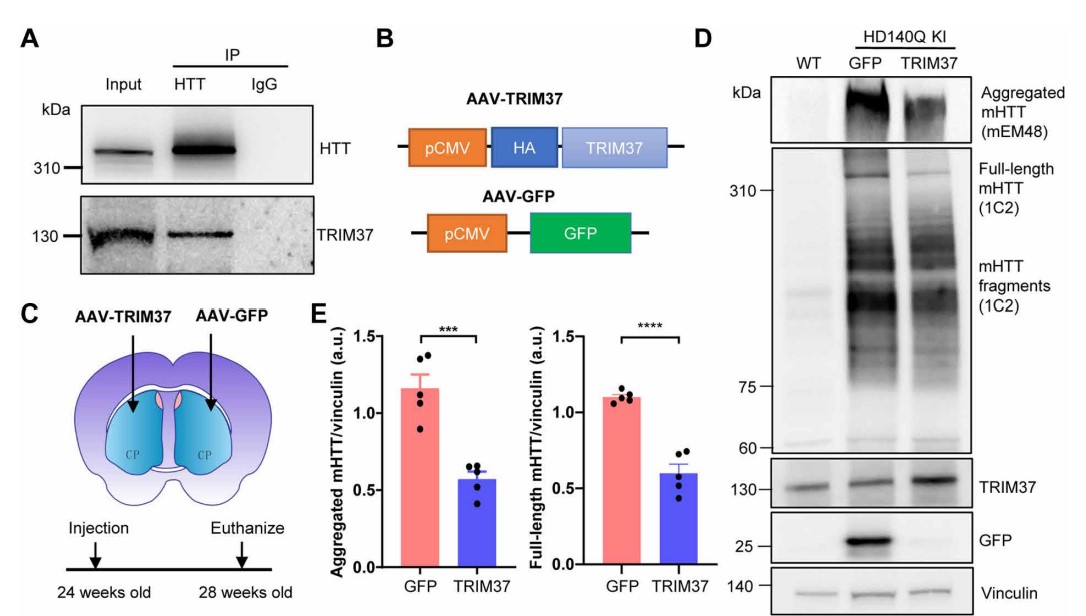
TRIM37在体内调节mHTT的聚集
图片来源:https://pubmed.ncbi.nlm.nih.gov/38758800/
本研究工作确立了非人类灵长类动物是HD研究的宝贵动物资源。虽然啮齿动物模型极大地扩展了对HD发病机制的理解,但固有的物种差异使它们无法解决与选择性神经退行性变相关的特定问题。
因此,研究非人灵长类动物可以填补目前HD研究中的这些概念空白。虽然建立HD的KI猴模型在技术上具有挑战性,且成本高昂,但本研究使用立体定位病毒注射在猴子的大脑中表达mHTT。未来的技术进步非常可取,使克隆基因编辑的猴子变得更容易。


