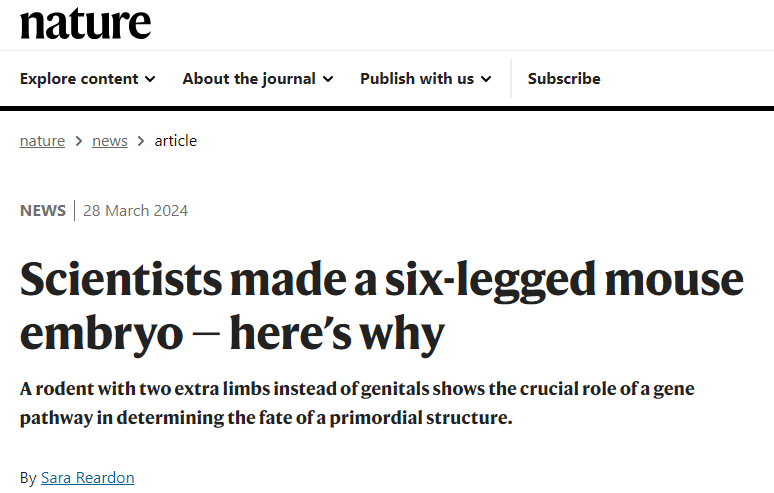
对这个遗传改变的胚胎的骨骼进行了三维重建,显示了它的额外肢体和正常肢体(分别为洋红色和绿松石色)(Credit: Anastasiia Lozovska et al/Nat. Comms)
Behind the Scenes
围肛中胚层(pericloacal mesoderm)的发育可塑性
围肛中胚层的独特性
围肛中胚层(pericloacal mesoderm)是一种特殊的中胚层组织,位于小鼠胚胎的后端,紧邻未来的泄殖腔(cloaca)区域。这一组织具有生成外生殖器结构的潜力。然而,在Tgfbr1条件性敲除(cKO)的胚胎中,这一区域被观察到可以产生额外的后肢结构,而非其原本的外生殖器命运。这一现象揭示了围肛中胚层在发育过程中的显著可塑性,意味着在特定的分子和细胞环境中,这一组织能够重新获得生成肢体结构的能力。
细胞亲和性的差异
细胞亲和性(cell affinity)是指细胞间相互吸引或排斥的能力,这影响了细胞聚集和组织形成的过程。在Tgfbr1-cKO胚胎中,虽然围肛中胚层和体节后肢原基(somatopleure-derived limb field)最初似乎是被共同诱导形成一个连续的原基,但它们之间的细胞亲和性可能存在差异。这种差异可能阻碍了这两种组织的混合,导致从围肛中胚层发展出的结构保持独立于体节后肢原基形成的正常后肢,从而在Tgfbr1-cKO胚胎中形成两个独立的后肢结构。
后肢与外生殖器的发育连接
在胚胎发育中,后肢和外生殖器通常被认为是来源于共同的原基(primordium)。然而,Tgfbr1的活动可能通过改变围肛中胚层染色质的可访问性,影响到后肢和外生殖器的发育。Tgfbr1可以调节某些关键的调控元件,使得它们对于特定的发育信号变得不再敏感或过度敏感,这样就改变了围肛中胚层中的细胞命运,促使它们向后肢的方向发展,而不是形成外生殖器结构。
组织可塑性对进化的意义
围肛中胚层的发育可塑性不仅在胚胎发育中具有重要作用,也可能在物种进化中起到了关键作用。例如,在某些爬行动物,如蛇中,后肢的退化可能与这种可塑性有关;而在某些蜥蜴中,则能够保留后肢结构。Tgfbr1介导的细胞命运改变和调控元件的可访问性调节,可能在这些进化过程中发挥了关键作用,影响了后肢和外生殖器的发育和演化路径。
Tgfbr1对染色质调控景观(chromatin regulatory landscape)的影响
通过ATAC-seq(测序)分析,该研究揭示了Tgfbr1如何在小鼠的pericloacal mesoderm中改变基因调控网络,促进了后肢的形成而非外生殖器的发育。
通过主成分分析(PCA)和层次聚类分析,研究团队发现了Tgfbr1调控下的基因表达模式变化。他们发现某些染色质区域在Tgfbr1作用下开放性增加,这些区域可能是控制肢体命运的关键调控元件。另一方面,一些原本在正常情况下参与外生殖器发育的染色质区域在Tgfbr1缺失的条件下开放性降低,暗示着这些区域在控制外生殖器形成中的重要作用。
尽管Tgfbr1信号通路的典型下游效应因子Smad在这一过程中并没有直接参与染色质区域的开放性调控,但其他因子如Hoxa13、Hoxd13和Isl1在这一过程中发挥作用。特别是,Tgfbr1可能通过调节这些因子对应的染色质区域的开放性,从而间接影响基因表达和细胞命运决定。
此外,研究还提出了一个模型,其中Tgfbr1通过确定哪些增强子元件(enhancer elements)对调控因子开放或不开放,从而调控pericloacal mesoderm的细胞命运。这种调控模式在解释了后肢和外生殖器共享许多调控输入信号的同时,还能产生如此不同的成熟结构提供了一个机制。
对其他生物系统的潜在影响
Tgfbr1基因及其编码的蛋白质TGF-β受体1 (TGF-β receptor 1) 在多种生物系统中发挥着关键作用,尤其在转移性癌症(metastatic cancer)和免疫功能(immune function)中的影响备受关注。这两个领域的研究揭示了Tgfbr1在细胞信号传导(cell signaling)、组织再生(tissue regeneration)、炎症反应(inflammatory response)等多种生物过程中的重要性。
转移性癌症
在转移性癌症领域,TGF-β信号通路(TGF-β signaling pathway)被认为在癌细胞的侵袭性、迁移(migration)和转移(metastasis)中起着双重作用。一方面,TGF-β在正常组织中通常起到抑制细胞增殖(cell proliferation)的作用,有助于维持组织稳态(homeostasis)。然而,在癌症进展的后期,癌细胞往往获得了对TGF-β抑制作用的抵抗力,TGF-β信号反而促进了癌细胞的侵袭和转移。这种现象被称为TGF-β悖论(TGF-β paradox)。Tgfbr1通过激活下游的Smad蛋白质和其他信号分子,可以调节细胞外基质(cellular matrix)的降解,促进癌细胞的运动性和侵袭性,从而在癌症转移中发挥关键作用。
免疫功能
在免疫系统中,Tgfbr1通过调节TGF-β信号,对免疫细胞的分化和功能产生深远影响。TGF-β是一种多功能细胞因子,能够影响T细胞(T cells)、B细胞(B cells)、巨噬细胞(macrophages)等多种免疫细胞的行为。特别是在调节T细胞分化方面,TGF-β能够促进调节性T细胞(regulatory T cells, Tregs)的生成,这些Tregs通过抑制过度的免疫反应,帮助维持免疫耐受(immune tolerance)和免疫平衡(immune homeostasis)。此外,TGF-β也参与了炎症反应中的抗炎过程,通过抑制促炎细胞因子(pro-inflammatory cytokines)的产生,减少组织损伤。
Tgfbr1及其信号通路在转移性癌症和免疫功能中扮演着复杂而重要的角色。其作用不仅与疾病的发生发展密切相关,还与机体维持正常生理状态的能力相关。这也意味着Tgfbr1及相关信号通路的潜在治疗应用,如在某些情况下抑制TGF-β信号可能有助于抑制癌症的转移,在其他情况下则可能需要激活TGF-β信号以增强免疫调节作用。然而,由于TGF-β信号在不同组织和发展阶段的多样作用,开发针对该通路的治疗策略需要高度的精确性和选择性。
双头阴茎(hemipenes)的发育的启示
该研究中发现的Tgfbr1调控后肢与外生殖器发育的机制可能为理解爬行动物中双头阴茎(hemipenes)的发育提供了一定的启示。爬行动物中的双头阴茎是一种特殊的生殖器官,存在于一些没有后肢的物种中,如蛇类。这种器官的发育可能涉及了与哺乳动物后肢与外生殖器发育中相似的发育可塑性(developmental plasticity)和基因调控网络。
在研究中,Tgfbr1通过改造染色质调控景观(chromatin regulatory landscape),调节了pericloacal mesoderm的细胞命运,促进了后肢而非外生殖器的发育。这一机制表明,Tgfbr1及其下游信号分子能够在发育过程中重塑基因表达,从而影响特定器官的形成。
对于爬行动物双头阴茎的发育,虽然具体的调控机制可能与哺乳动物存在差异,但Tgfbr1信号通路在调节细胞命运和器官形成方面的通用作用可能同样重要。特别是在没有后肢的情况下,Tgfbr1及相关信号通路可能在调节原始器官(primitive organs)如双头阴茎的形成中起到关键作用,例如通过调控与后肢发育共享的基因表达模式,或是通过促进特定细胞群体的分化。
此外,爬行动物双头阴茎的独特发育模式也可能涉及其他特异性的调控因子和信号通路。例如,一些特定的同源框基因(homeobox genes)和生长因子可能在调控这一过程中发挥作用。进一步的研究需要揭示这些信号通路如何在不同生物系统中被共同利用和改造,以适应各自独特的发育需求和生态位。
虽然Tgfbr1调控机制在爬行动物双头阴茎发育中的适用性需要更多的实验数据来证实,但该研究提供的机制可能对理解爬行动物中类似器官的形成提供了有价值的视角。探索不同生物之间共享的调控模式不仅能增进我们对生物多样性的理解,还可能揭示进化过程中保守的发育策略。
研究的意义与影响
该研究通过探索Tgfbr1在调控小鼠后肢和外生殖器之间的发育可塑性中的作用,对遗传学(genetics)、发育生物学(developmental biology)和进化论(evolutionary theory)做出了重要贡献。
在遗传学领域,该研究揭示了Tgfbr1及其信号通路如何通过调控染色质的可访问性(chromatin accessibility)影响特定基因的表达。这种调控机制不仅展示了单个基因如何在复杂的生物学过程中发挥作用,还突显了表观遗传学(epigenetics)在调控基因表达中的重要性。此外,通过揭示Tgfbr1在不同器官发育中的特定作用,该研究也为理解基因如何在特定组织和发育阶段中发挥功能提供了见解。
在发育生物学领域,该研究提供了一个关于Tgfbr1如何通过改造染色质调控景观影响组织发育的案例。这不仅增强了我们对于哺乳动物肢体发育的理解,还揭示了器官发育的深层调控机制。特别是,该研究表明,即使在进化上距离较远的器官(如后肢和外生殖器)之间也存在发育可塑性,这种可塑性由共享的调控网络支持。此外,该研究还强调了调控因子在维持发育稳定性和允许器官多样性中的重要作用。
从进化论的角度看,该研究提供了一个示例,说明单个调控因子如Tgfbr1如何在不同物种和器官中保持其功能的同时,也支持了形态的多样性和适应性。这种调控因子的保守性和可塑性是理解进化过程中形态多样性演化的关键。特别是,该研究通过揭示哺乳动物器官发育中的调控机制,为比较进化发育学(comparative evolutionary developmental biology,简称“evo-devo”)提供了新的见解,有助于理解不同生物之间共享的发育策略和适应性演化。